CrystalsFirst
Philipps-Universität Marburg
Stefan Merkl, Fu Kan, Glinca Serghei
Philipps-Universität Marburg
CrystalsFirst wendet innovative Technologien an, welche den komplexen Prozess der Arzneistoffsuche rationalisieren und den finanziellen und zeitlichen Aufwand reduzieren.
Probleme mit dem Stand der Technik
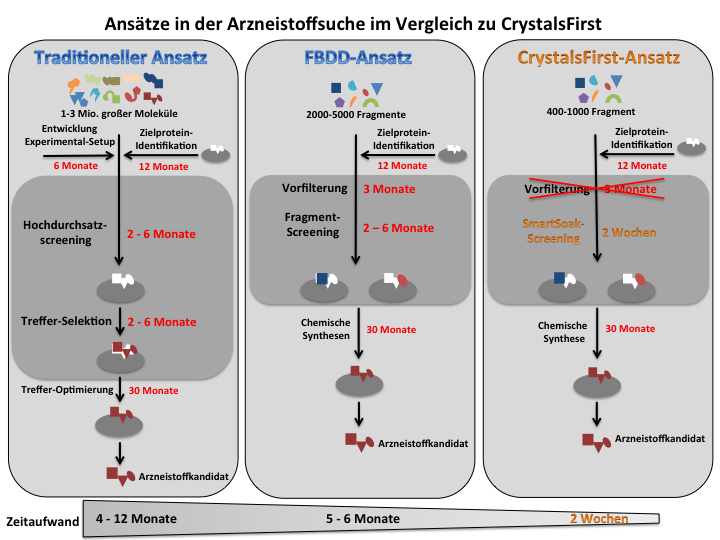
Die traditionelle Arzneistoffsuche screent mit hohem, instrumentellem Aufwand Substanz-Bibliotheken, die 1-3 Mio. Moleküle enthalten, um mögliche Arzneistoffe zu identifizieren. Doch dieser Ansatz steht wegen des enormen Aufwands, hoher Kosten, langer Entwicklungsdauer, hoher Ausfallraten in klinischen Studien seit vielen Jahren stark in der Kritik. Als rationalere Alternative hat sich inzwischen die sogenannte Fragment-Based Drug Discovery (FBDD) etabliert. In der FBDD werden wesentlich kleinere Bibliotheken mit vergleichsweise sehr kleinen Molekülen, den sogenannten Fragmenten, gescreent. Man kann Fragmente als Grundgerüste auffassen, aus denen größere arzneistofftaugliche Verbindungen entwickelt werden. Ein weiterer Unterschied zum traditionellen Ansatz ist, dass FBDD in den Screenings vermehrt auf Strukturaufklärung setzt. Zu diesem Zweck müssen die Zielproteine zunächst kristallisiert werden. Danach werden sie in Lösungen mit Fragmenten getränkt, ein Prozess, der als Soaking bezeichnet wird. Anschließend werden mittels Röntgenstrukturanalyse Daten erhoben, aus denen sich 3D-Modelle generieren lassen. Die Modelle geben nicht nur Aufschluss darüber, welche Fragmente an die Zielstruktur binden. Sie geben auch Aufschluss über die genaue räumliche Positionierung des Fragments in der Zielstruktur. Aus diesen Kenntnissen können im Folgenden Ideen für chemische Modifikationen an dem Grundgerüst abgeleitet werden, welche eine rationale Weiterentwicklung des Fragments bis hin zu einem passgenauen Arzneistoffkandidat ermöglichen. Allerdings sind die Kristallisation und das Soaking aufgrund des hohen Trial & Error-Optimierungsbedarfs der Experimentalbedingungen entscheidende Flaschenhälse des Ansatzes.
Lösung
CrystalsFirsts innovative SmartSoak-Technologie eliminiert den Flaschenhals der Soaking-Optimierung, indem sie das traditionelle Trial & Error-Verfahren erstmals durch ein systematisches Standardverfahren ersetzt. Die Kombination aus der SmartSoak-Technologie und einem rein Kristallographie-basiertem FBDD-Ansatz erlaubt eine deutliche Beschleunigung von Screenings und einen rationaleren Entwicklungsprozess u.a. hinsichtlich passgenauerer Arzneistoffe, höheren Innovationspotentials, besserer Kontrolle von molekularen Eigenschaften (bzgl. Nebenwirkungen), Reduktion von Ausfallraten in klinischen Studien.
Weitere Projekte
Mit freundlicher Unterstützung